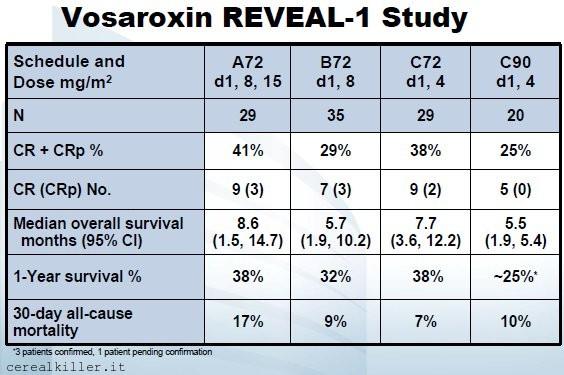
La notizia del fallimento di Palifosfamide nella fase 3 condotta da Ziopharm (ZIOP) mi ha spiazzato e per qualche istante ho pensato di rimandare l’articolo che invece ora state leggendo, relativo a Sunesis (SNSS). Ziopharm non mi ha sorpreso per il risultato dello studio, che avevo già ipotizzato da tempo, quanto per la modalità della diffusione della notizia. La compagnia aveva creato un perfetto evento binario, quando annunciò che l’ultima settimana di marzo avrebbe diffuso i dati di PICASSO III. Mi aspettavo una comunicazione che facesse riferimento ad una conferenza nella quale i dati sarebbero stati illustrati ed al momento della stesura dell’articolo sullo studio ero realmente convinto che sarebbero passati dei giorni prima dell’esito e che convocare un’assemblea avrebbe consentito a chi ancora aveva il titolo in portafoglio di decidere sul da farsi. Niente di tutto questo si è avverato. Fatta questa piccola premessa, che riprenderò quando approfondirò l’argomento Ziopharm nei prossimi giorni, passerei volentieri a parlare dell’argomento del giorno: Sunesis e la sua fase 3. Qui lo scenario cambia in tutto e per tutto, a cominciare dall’orizzonte temporale, visto che non esiste il rischio di trovarsi con un pugno di mosche in mano, ne fra qualche giorno, ne fra qualche settimana. VALOR è lo studio registrativo che vede vosaroxin, farmaco di punta di Sunesis, impiegato nel trattamento della leucemia mieloide acuta (AML per comodità) in pazienti recidivi o refrattari. Si tratta di un trial in doppio cieco nl quale i pazienti vengono randomizzati per ricevere vosaroxin o placebo in combinazione con citarabina, un analogo nucleosidico normalmente impiegato in questi casi. Vosarixin in una fase 2 chiamata REVEAL-1, con criteri di inclusione simili a VALOR, ma con il farmaco impiegato in prima linea, ha fatto registrare una sopravvivenza globale di 7,7 mesi ed un tasso di risposta del 29%, dati che in una malattia dalla prognosi così infausta hanno giustificato il prosieguo della sperimentazione.

I risultati dello studio REVEAL-1. Sunesis ha testato vosaroxin in diverse somministrazioni, stabilendo poi che la migliore fosse quella impiegata nel braccio “C”. Difficile stabilire un effettivo vantaggio, visto che quello era probabilmente anche il braccio meno difficile da trattare.
Vosaroxin però si trova anche in un altro studio di fase 3 chiamato LI-1 e quello che accomuna LI-1 e VALOR è l’originalità e la intelligenza dei disegni. LI-1 si rivolge a pazienti con AML e più di 60 anni di età ed è concepito con un disegno “pick a winner”, ossia un certo numero di interventi verso i quali i pazienti sono randomizzati ed a intervalli regolari si controlla quali stiano avendo maggior successo, in questi ultimi quindi si espande l’arruolamento. L’idea è quella di concentrare i pazienti nei trattamenti con maggior efficacia ed abbandonare quelli inutili. Tipo playoff. Questi i trattamenti di LI-1 (che per la cronaca sta per “Less Intensive 1”):
- Ara-C a basso dosaggio (citarabina): 20 mg BID (due volte al di) per 10 giorni ad intervalli di 28 e 42 giorni.
- Sapacitabine: 300mg BID (qui almeno c’è il vantaggio della somministrazione orale) per 3 giorni consecutivi nelle prime due settimane alle quali deve far seguito un periodo di almeno un mese senza somministrazioni.
- Vosaroxin: dosaggio di 72mg/m2 ai giorni 1 e 4 di ogni ciclo.
- Ara-C e Vosaroxin: stesso dosaggio illustrato sopra.
- Ara-C a basso dosaggio e AC220: Ara-C sempre allo stesso dosaggio ed AC220 a 135mg, 90mg o 60mg una volta al di a stomaco vuoto per 21 giorni consecutivi per ciclo di trattamento.
- Ganetespib ed Ara-C a basso dosaggio: lo studio prevede che si possano aggiungere altri composti, come nel caso dell’HSP90 inibitore di Synta (SNTA).
Per quel che riguarda l’arruolamento, la prima fase è quella di inserire 50 malati in ogni braccio, per poi espandere il numero di pazienti man mano che l’efficacia del farmaco ne rende consigliabile l’impiego. Recentemente Sunesis ha aggiornato il numero di pazienti inseriti nel trial che attualmente ammonta a 43 per il braccio in monoterapia e 19 per la combo, e che il traguardo dei 50 pazienti del braccio con il solo vosaroxin verrà raggiunto verso metà anno, mentre si andrà a fine 2013 per la combinazione con citarabina. Raggiungere quota 50 significa eseguire la prima analisi ad interim, quindi avere un primo responso. VALOR è una fase 3 in doppio cieco e randomizzata nella quale vosaroxin viene somministrato (sempre per infusione ai giorni 1 e 4 del ciclo di trattamento ed al dosaggio di 90 mg/m2 per l’induzione e di 70 mg/m2 per tutti gli altri cicli) assieme a citarabina (1g/m2 ai giorni 1 e 5). Lo scopo dello studio è verificare se vi sia un miglioramento in termini di sopravvivenza rispetto a citarabina e placebo. La particolarità dello studio disegnato da Sunesis è di essere adattativo, motivo in virtù del quale a settembre è stata effettuata un’analisi ad interim che prevedeva la possibilità di arrestare lo studio (per efficacia o futilità), di farlo continuare così come previsto o di allargare l’arruolamento per ottenere un dato statisticamente più significativo. Il DSMB (il comitato che doveva prendere la decisione) si espresse in modo unanime per l’ultima ipotesi e Sunesis quindi ha ripreso ad arruolare altri 225 pazienti. Sunesis intende arrivare entro fine anno ai 675 pazienti richiesti e conta di raggiungere i 562 eventi necessari per togliere il cieco dal trial per la metà del 2014. C’è tempo quindi per i dati, ma a differenza di Ziopharm e di PICASSO III, in questo caso abbiamo un forte indizio di come stia andando lo studio, ossia: sta andando bene. Non talmente bene da far considerare l’ipotesi di uno stop per efficacia, ma le possibilità erano quasi nulle, ma abbastanza bene da richiedere un allargamento dello studio per mantenere una adeguata potenza dal punto di vista statistico a conforto dei vantaggi del farmaco di Sunesis rispetto al controllo. Lo ripeto, questo non significa che di sicuro la fase 3 sarà un successo, significa solo che la prima analisi ha dato un giudizio molto confortante. Anche qui un appuntamento per metà anno, anche se notevolmente di minor entità, l’analisi sulla sicurezza del farmaco. Sunesis ha l’unico farmaco in fase 3 per pazienti con AML r/r e la concorrenza sta perdendo colpi. La compagnia aveva in cassa a fine 2012 la bellezza di 71 milioni di dollari, il che dovrebbe essere sufficiente per tutto il 2013 e gran parte del 2014. La copertura sarebbe quindi garantita per quanto concerne la diffusione dei dati di VALOR, non l’eventuale richiesta di approvazione. Il primo evento potrebbe essere costituito dall’analisi ad interim di LI-1, evento che dovrebbe accadere circa 2 mesi dopo la chiusura dell’arruolamento della prima fase, ossia del cinquantesimo paziente. Se guardiamo ai farmaci impiegati in questo studio possiamo concludere che escluso Ganetespib (che però in ambito ematologico ha ancora molto da dimostrare) la concorrenza non è particolarmente agguerrita. AC220 di Ambit è stato recentemente rispedito al mittente da Astellas, che ha restituito i diritti del farmaco agli originali proprietari dopo che il farmaco ha ottenuto datia mio avviso incoraggianti uniti ad un profilo tossicologico non propriamente invidiabile, anche se su questo aspetto ci sarebbe da discutere:
“While our decision is based on strategic reasons, we are proud of our collaborative work with Ambit, and we are committed to working with Ambit on a smooth transition,” said Yoshihiko Hatanaka, President and CEO of Astellas. “We remain committed to the field of Oncology as a major area of focus for the company and will continue to pursue our goal of becoming a Global Category Leader in Oncology.” Michael Martino, President and CEO of Ambit, said, “With the Phase 2 study results for quizartinib that were presented at the ASH Annual Meeting last December, we and members of the medical community continue to be excited about quizartinib and its potential to meet a significant, unmet need in acute myeloid leukemia (AML) patients. We are fully committed to moving forward with the Phase 3 clinical trial plan and look forward to advancing this important drug candidate toward approval.”
I dati in questione presentati lo scorso ASH si riferivano ad una coorte di 134 pazienti con almeno 60 anni e AML r/r dei quali 92 con mutazione FLT3-ITD, ossia il bersaglio del farmaco, un FLT3i. Ambit ha ottenuto un 54% di tasso di risposta con una durata mediana di 12,7 settimane ed una sopravvivenza di 25,3 settimane per quanto concerne la popolazione con FLT3 mutato contro il 32% di risposte con durata mediana di 22,1 settimane e sopravvivenza di 19 per il resto dei pazienti.
Sunesis, in prima linea contro l’AML.
Detto che VALOR è l’unica fase 3 in corso attualmente in pazienti con AML r/r (per quel che ne so, ovviamente), il naturale sviluppo del farmaco nel caso vada tutto bene è l’impiego in prima linea e nelle sindromi mielodisplastiche. REVEAL-1 ha dato una prima indicazione, per il resto si passa da LI-1.
I dati preliminari suggeriscono che nel campo dell’AML r/r AC220 sia un concorrente con il quale Sunesis può gareggiare senza timore. Non vi inganni l’alto tasso di risposta, come ha dimostrato clofarabine di Genzyme recentemente, un alto tasso di risposta non sempre si traduce in un vantaggio in termini di sopravvivenza. AC220 poi sembra efficace più che altro in presenza di mutazioni FLT3, il che è un vantaggio per la determinazione dei pazienti migliori da trattare, ma un’ostacolo in termini di popolazione da servire, quindi di mercato. La restituzione dei diritti poi, dopo i dati presentati ad ASH12 che sembrano molto promettenti, ha un retrogusto che sa di pericolo. AC220, ammesso che trovi un partner, entrerebbe in fase 3 con un ritardo notevole rispetto a vosaroxin.
Ultime due cose su Sunesis: le paretnership con Biogen e Millennium. Se della prima non sapremo nulla di nuovo fino al 2014, della seconda qualche dettaglio l’abbiamo. Sappiamo che il farmaco in fase più avanzata inerente alla partnership è il pan-RAF inibitore MLN 2480. Mi aspetto che ad ASCO13 si parli di questo farmaco, per quanto riguarda la fase 1/2 nella quale è coinvolto. I dati, se presentati in quell’occasione, verteranno sulla porzione del trial con dosaggio scalare e dovrebbero consentire di individuare la strada migliore per proseguire la sperimentazione. Ovviamente, visto quanto accaduto con zelboraf e dabrafenib, un’occhio di riguardo al melanoma ci starebbe tutto. So cosa state pensando, il futuro in questo senso è la combo MEK e BRAF inibitore. L’ho ripetuto fino alla nausea, quindi non starò certo qui a negarlo ora. Ma che ne dite di un panRAF inibitore impiegato assieme ad un interessante ed allosterico MEKi come TAK733?