Nella prima parte dell’articolo dedicata ad ESMO 2012 ho brevemente presentato 3 delle compagnie che seguo e che avrebbero fatto presenza alla kermesse viennese, oltre ad aver accennato ad AP26113, ultimo gioiello in casa Ariad (ARIA). Mi occuperò di tutte nel più breve tempo possibile, oltre a dedicare spazio anche ad altre realtà di un certo interesse emerse durante il convegno.
Nella prima parte dell’articolo dedicata ad ESMO 2012 ho brevemente presentato 3 delle compagnie che seguo e che avrebbero fatto presenza alla kermesse viennese, oltre ad aver accennato ad AP26113, ultimo gioiello in casa Ariad (ARIA). Mi occuperò di tutte nel più breve tempo possibile, oltre a dedicare spazio anche ad altre realtà di un certo interesse emerse durante il convegno.
Sono impressionato dal numero di messaggi, mail e contatti avuti nel fine settimana. Nel 90% dei casi l’oggetto della discussione è stato Exelixis (EXEL) ad ESMO, quindi oggi si parla soprattutto di questa. Ariad (ARIA), Synta (SNTA) e Threshold (THLD), che secondo me hanno offereto spunti più interessanti, saranno oggetto dei prossimi articoli, anche perché ci sarà parecchio da discutere…
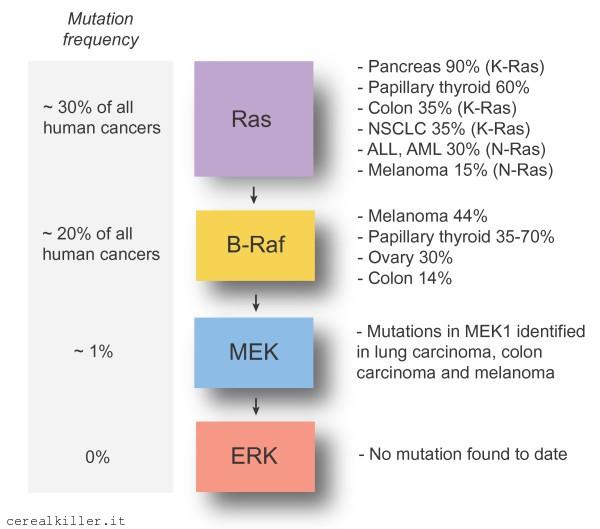
Cabozantinib, farmaco di punta della compagnia, è abituato ad essere presente nei congressi in modo massiccio e con dati impressionanti e se non fosse per un management al limite del masochistico, il titolo probabilmente quoterebbe quattro volte tanto. Questa edizione del congresso non ha visto solo Cabozantinib sotto i riflettori, dato che anche XL 518/ GDC 0973 ha fatto bella mostra di se. Pochi i dati, profilo di sicurezza da passare al microscopio ma la sostanza è che Roche porterà il farmaco nella terapia di combinazione sperimentata in questa fase 1, in fase 3. Conoscete tutti il contenuto della PR, ma riporto i dettagli più interessanti:
The Phase Ib dose escalation study was designed to evaluate the safety and tolerability of vemurafenib in combination with GDC-0973. The study was not designed to measure efficacy.
Study Results
As of July 6, 2012, 70 patients had been treated. The majority of patients (74.3%) had Stage IV, M1c melanoma at the time of enrollment, and 54.3% had disease progression following prior treatment with vemurafenib. The median number of prior treatment cycles to date was three. Six of the 10 dose escalation cohorts have met the protocol-specified criteria for safety. One dose-limiting toxicity (Grade 3 QT interval prolongation) was observed out of six patients in the dose escalation stage receiving 960 mg of vemurafenib and 60 mg of GDC-0973 on a 21/7 day schedule. Two cohorts receiving 60 mg of GDC-0973 on a 21/7 day schedule with vemurafenib at 720 mg and 960 mg were selected for expansion.
[…] Selected AEs attributed to either vemurafenib or GDC-0973 were: creatinine phosphokinase elevation (20.0%; 4.3%), liver function test elevation (20.0%; 4.3%), arthralgia (12.9%; 1.4%), serous choreoretinopathy (4.3%; 0%), and cutaneous squamous cell carcinoma (1.4%; 1.4%).
[…] No patients receiving the combination of vemurafenib and GDC-0973 discontinued treatment due to an adverse event.
All 24 BRAFi-naïve patients evaluable for tumor responses had a decrease in tumor size from baseline, however, further follow-up is required to determine the confirmed objective response rate.
Poi c’è il pezzo che preferisco:
Roche has disclosed that it intends to evaluate the combination of vemurafenib with GDC-0973 versus vemurafenib in a multicenter, randomized, double-blind, placebo-controlled Phase III trial in previously untreated patients with BRAFV600 mutation positive, unresectable locally advanced or metastatic melanoma.
Non serve un genio per capire che se Roche decide di portare il tutto al livello di uno studio registrativo, significa che del buono ci vede. Noi non abbiamo tutti i dettagli ma sappiamo che tutti i pazienti valutabili non precedentemente trattati con BRAF inibitori hanno ottenuto un restringimento della massa tumorale. Non sappiamo di quanto, non possiamo quindi nemmeno sapere in che misura siano risposte complete o parziali, ma abbiamo un ulteriore conferma che la strategia di abbinare BRAF e MEK inibitori ha un potenziale.
Altro abstract che merita attenzione e che riguarda Cabozantinib è quello relativo al dosaggio a 40mg. Molto sottovalutato, a mio parere.
Anche qui, breve resoconto:
The interim results reported today include data from 51 men enrolled in the 40 mg NRE cohort of an ongoing phase 2 randomized discontinuation trial. All patients had bone metastases on bone scan and 41% had measurable soft tissue disease. All patients had received prior docetaxel, 67% had received prior abiraterone or enzalutamide (MDV3100), and 25% had received prior cabazitaxel. […] Clinically significant pain, defined as baseline pain score by Brief Pain Inventory (BPI) ≥4, was present in 53% of patients, with 45% of these patients receiving chronic narcotic administration.
Bone Scan Response (BSR). Computer-assisted evaluation of bone scan lesion area (BSLA) was performed and response evaluated by an Independent Radiology Committee (IRC). An overall BSR rate (complete response + partial response) of 49% was observed, with another 29% of patients having stable disease, and 14% having a best response of progressive disease.
Soft Tissue Response. Twenty-one patients had measurable soft tissue or visceral lesions at baseline and 19 patients had at least one post-baseline assessment. Evidence of tumor regression was seen in 79% of the 19 patients with at least one post-baseline assessment. Overall response by RECIST among 21 patients with at least baseline data was partial response in 10%, stable disease in 71%, and progressive disease in 10%. Soft tissue responses were independent of prior therapy.
Pain Palliation. In 26 patients with clinically significant baseline pain, the median maximal reduction in pain from baseline was 49%. A clinically significant reduction of pain, defined as a ≥30% decrease in BPI pain score, was observed in 18 patients (69%).Fifty-four percent of patients decreased their use of narcotics, including one patient who discontinued narcotics. The majority of patients in whom these improvements were observed had received both prior docetaxel and prior abiraterone or enzalutamide.
[…] Progression-Free Survival (PFS). Analyses of PFS based on radiographic progression per IRC in soft tissue and/or bone included either the total population (N=51) or only patients who had received prior docetaxel and abiraterone (N=32). Median PFS was 4.1 months for both the total population and for patients who had previously received docetaxel and abiraterone. The median treatment duration was 4.7 months (range: 0.3 – 8.8+ months).
Siamo ai soliti risultati ottimi, sia dal punto di vista delle immagini, con qualsiasi mezzo le si voglia acquisire, sia dal punto di vista dei biomarker, sia dal più semplice dei concetti: se il paziente smette con gli antidolorifici o comunque ne riduce l’impiego, l’effetto non può essere ignorato. Cabozantinib agisce sulle metastasi ossee e sui tessuti molli e la mPFS è indipendente dal precedente impiego di docetaxel e Zytiga. Da notare che lo studio ha arruolato una considerevole quantità di pazienti precedentemente trattati anche con MDV 3100.
Non cambia molto in ottica long. A dire il vero, nemmeno in ottica di breve…