Astex (ASTX) la scorsa settimana ha illustrato quello che è lo stato di sviluppo della pipeline, con particolare riferimento alla seconda generazione del farmaco che finora ha permesso alla compagnia di mantenersi in salute dal punto di vista economico e di chiudere il bilancio 2012 con 138 milioni di dollari in cassa contro i 128 milioni dell’anno precedente. Questo, considerando che il processo che sta consentendo la transizione dalla inconcludente Supergen alla Astex che sta prendendo forma sotto i nostri occhi sia costellato di studi clinici, il che significa spendere parecchie risorse monetarie. Dacogen è il carburante che alimenta le casse di Astex, SGI 110 il suo seguito naturale.
Astex considera SGI 110, al pari dell’HSP90 inibitore AT 13387, il progetto prioritario della compagnia per quel che riguarda la pipeline in fase di sviluppo. Sono d’accordo su SGI 110 (uno dei motivi per cui Astex è entrata a far parte del portafoglio virtuale), meno su AT 13387 che considero (come praticamente il resto dei farmaci simili in circolazione) inferiore a Ganetespib. L’altro motivo per cui il titolo si trova nella custodia titoli del blog è LEE 011, CDK 4/6 inibitore in licenza a Novartis ed inserito poco tempo fa in una lista contenente i farmaci più interessanti (a mio modesto avviso) nelle mani delle piccole aziende biotech quotate al Nasdaq. Se ricordate, più che il valore dimostrato sul campo LEE 011 gode di una reputazione costruita sul meccanismo d’azione, il che come al solito non è garanzia di successo, ma da un senso alla decisione di sperimentarlo in condizioni simili a quelle di farmaci che hanno mostrato di fornire dati incoraggianti, come nel caso di PD 0332991 di Onyx (ONXX), del quale vi ho già parlato.
SGI 110 si trova in fase 1/2 ed è strategicamente importante per Astex più di quanto non si possa immaginare.
Dacogen lo scorso anno è stato approvato in Europa per il trattamento della leucemia mieloide acuta (AML) in pazienti con 65 anni e più, mentre negli Stati Uniti FDA ha risposto negativamente alla domanda di Astexa. L’AML è di per se una malattia con prognosi infausta, il che è particolarmente vero per i pazienti più anziani, per i quali si può parlare giustamente di esigenza medica insoddisfatta. La buona notizia, per i pazienti, è che nuovi ed efficaci trattamenti si stanno affacciando al panorama clinico. La brutta notizia per Astex è che questi nuovi farmaci sono superiori a Dacogen. Considerando il potenziale economico di un simile farmaco, e la dipendenza della compagnia dalle royalties percepite sulle vendite di dacogen (che ha anche una certa età, il che per un farmaco significa competizione da parte dei generici e nello specifico quest’anno per gli USA siamo al capolinea), avere un degno successore in casa può fare tutta la differenza di questo mondo.
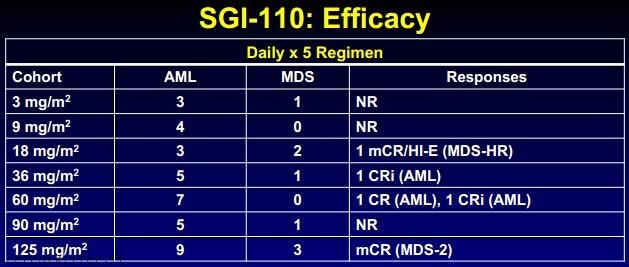
SGI 110 è la versione inattiva del blockbuster della compagnia ed è particolarmente interessante, oltre che per il potenziale terapeutico, anche per la possibilità di somministrarlo per via sottocutanea. Grazie ai dati presentati allo scorso ASH, sappiamo che il farmaco ha un profilo farmacocinetico per il quale l’emivita è 4 volte superiore rispetto a dacogen ed una efficacia indipendente da eventuali precedenti somministrazioni di altri agenti ipometilanti, sia per quanto riguarda pazienti con AML che con sindromi mielodispastiche (MDS). Astex ora sta portando lo studio nella porzione di fase 2 nella quale i pazienti, compresi alcuni naive ad ogni trattamento,verranno trattati con il dosaggio e la modalità di somministrazione ritenuta migliore. Nuovi aggiornamenti del trial arriveranno ad ASCO13 ed al meeting dell’European Hematology Association a giugno ma è ipotizzabile che assisteremo ad un monitoraggio continuo attraverso tutto l’anno; la compagnia ha anche iniziato altri due studi nel trattamento del carcinoma ovarico e di quello epatocellulare (HCC) in seconda linea e da questi due studi più quello di cui parlavo poc’anzi conta di determinare quale sarà la principale indicazione da portare in fase registrativa.
Dacogen in USA è stato considerato non meritevole di approvazione da parte di FDA per il mancato beneficio in termini di sopravvivenza. Lo scorso ASH ha visto nuovi agenti come quizartinib e volasertib raggiungere tassi di risposta ben superiori rispetto a quelli fatti registrare da dacogen in passato, ma vantaggio in termini di sopravvivenza solo parzialmente incoraggianti. Il farmaco di Astex in prima linea fa registrare 7,7 mesi in prima linea, volasertib 8 mesi quando abbinato a citarabina a basso dosaggio (LoDAC) e quizartinib 5,8 mesi in un sottogruppo selezionato (FLT3+) ma in seconda linea ed in una popolazione dai 60 anni in su e con uno stratosferico tasso di risposta del 53%. Dal punto di vista della tollerabilità i farmaci appena menzionati possiedono un profilo non del tutto confortante anche se in linea con quello del farmaco di Astex, il che si può giustificare proprio in virtù del fatto che per pazienti anziani con AML le opzioni sono quasi del tutto inesistenti.

Con queste premesse, risulta evidente quanto SGI 110 sia di vitale importanza per Astex. Il fatto che per tutto l’anno poi ci saranno aggiornamenti riguardo i dati degli studi clinici nei quali il farmaco è coinvolto, un buon motivo per tenere il titolo in portafoglio.
Mine, abbiam capito, non si cucca niente…… 😛
E, intanto, ARRY fa pena, per non dire peggio. Il prode, almeno per ora, contiene le perdite.
Rialzo la posta, se mi va bene con CLSN si punta a Capo Verde per l’estate. Vi dirò.
A Bruno, che suppongo sia il vero nome di uno che si manifesta con un nick, e a tutti, come li ha definiti CK, i miei ammiratori ricambio cordialissimi saluti. Quanto a te, mio caro Andrea, credo ne abbia a sufficienza a casa di impegni senza doverti sobbarcare un’eventuale andata in quel di Castrozza. 😀
Ma….parliamo anche di titolini. ARRY non fa che salire e scendere come un otto volante, tanto che m’ha pure stufata; ACHN, ecco dal prode Achille m’aspettavo qualcosina di più, ma tant’è. Ho le mani, per non parlare dei cordoncini della borsettina (tutto declinato in ini perché son pochi i soldini), legate: finché non riesco a vendere in guadagno uno di questi due posso solamente stare a guardare. Ahimé……
Oh, Elisa, ne approfitto per riportare i saluti che inviano a te… attraverso me. L’ultimo in ordine di tempo è Bruno, ma hai uno stuolo di ammiratori pronti ad accompagnarti a S. Martino di Castrozza se vuoi… io mi offro volontario per fare il terzo incomodo, (o moccolo, come si diceva ai miei tempi), basta che mi pagate da mangiare.
A dire il vero, caro CK, Mine ci doveva portare A SUE SPESE a Livigno per un weekend. La mia sola obiezione è che io preferisco San Martino di Castrozza.
Patrick, credo che chiunque stia seguendo il titolo si aspettasse un’approvazione accelerata, quindi… comunque articolo in arrivo, se riesco oggi
Astex vola! Il motivo del crollo di cldx invece? Poca fiducia nel disegno della fase 3 o qualcuno pensava che la fase 3 non si sarebbe fatta?
Oncolytics Biotech Inc. (“Oncolytics”) (TSX:ONC) (NASDAQ:ONCY) today announced that it has completed patient enrollment in a Phase 2 clinical trial evaluating intravenous administration of REOLYSIN® in combination with paclitaxel and carboplatin in patients with non-small cell lung cancer (NSCLC) with Kras or EGFR-activated tumours (REO 016).
This trial is a single arm, single-stage, open-label, Phase 2 study of REOLYSIN given intravenously with paclitaxel and carboplatin every three weeks. Patients received four to six cycles of paclitaxel and carboplatin in conjunction with REOLYSIN, following which REOLYSIN could be continued as a monotherapy.
Eligible patients included those with metastatic or recurrent NSCLC with Kras or EGFR-activated tumours, who had not received chemotherapy treatment for their metastatic or recurrent disease. Patients must have demonstrated mutations in Kras or EGFR, or EGFR gene amplification in their tumours (metastatic or primary) in order to qualify for the trial.
The Company previously reported in November 2012 that 33 patients had received Reovirus (REOLYSIN) (3 x 1010 TCID50) intravenously daily on days one to five, in combination with carboplatin and paclitaxel. Molecular tumor demographics included: 16 Kras, three EGFR, four BRAF mutations, and 10 EGFR amplified only. Response evaluation data reported among 30 evaluable patients showed 27 patients had stable disease or better for a 90% clinical benefit rate (nine partial response (PR) (30%) and 18 stable disease (SD) (60%)). Three patients had progressive disease (PD) as their best response.
“We have seen encouraging results in both this and other trials looking at primary and metastatic lung disease and are continuing to push our lung program forward on that basis,” said Dr. Brad Thompson, President and CEO of Oncolytics. “We have extended our work in this indication beyond this drug combination and are currently evaluating REOLYSIN in conjunction with docetaxel or pemetrexed in a second line open-label, randomized, non-blinded, Phase II clinical study sponsored by the NCIC Clinical Trials Group at Queen’s University in Kingston, Ontario that will enroll up to 150 squamous cell and adenocarcinoma of the lung patients.”