Queste per me saranno giornate piuttosto impegnative. ASCO è partito, anche se non con i fuochi d’artificio nei quali speravo. Poche cose interessanti o meglio, poche cose nuove ed interessanti. Come già anticipato nei precedenti articoli questa edizione è quella dell’immunoterapia e come da copione una delle cose più interessanti riguarda nivolumab ed ipilimumab. Non dico la più interessante, giusto perché gli abstract sono appena sfornati e ce n’è una quantità industriale de leggere, ma non credo di andare troppo lontano dal vero nell’affermare che la combo di BMS si troverà comunque sul podio a fine ASCO.
A me però interessa in prima battuta quello che riguarda il portafoglio virtuale, come sapete. Viste le richieste, si comincia con Curis, Array e Molmed. Lo so, quest’ultima con il portafoglio non ha nulla a che fare, ma interessa a molti e comunque ho intenzione di dar spazio alle europee, visto che molte delle più interessanti novità in ambito farmaceutico arrivano dal nostro continente. Sfortunatamente, di italico vi è poco rispetto a quanto prodotto dal nord Europa, ma questo è un’altro discorso.
Inizio da Curis, quindi. Vediamo l’abstract di CUDC 427:
Background: GDCE0917 is a small molecule that triggers tumor cell apoptosis by selectively antagonizing IAP proteins. Preclinical studies demonstrated antitumor efficacy of GDC-0917 alone or in combination with chemotherapeutic agents.
Methods: Oral GDC-0917 was given on Day (d) 1 followed by 2d off and a 2-week (w) on/ 1w off treatment (tx) schedule (21d cycle) starting d4. A modified continual reassessment method was used for dose escalation. Dose-limiting toxicity (DLT, assessed d1-24), PK, adverse events (AEs), pharmacodynamics (PD), and clinical activity were evaluated.
Results:42 pts of age 36-86 (median 60.5) were enrolled in 11 cohorts (5-600 mg) and received 1-15 cycles (median 2) of GDC-0917. One DLT, Grade (G) 3 fatigue, was observed at 450 mg. The maximum tolerated dose was not determined although plasma concentrations of preclinically defined IC90 were reached. The most frequent AEs were diarrhea, fatigue and nausea (26.2% each), vomiting (23.8%), and constipation (19%). The most frequent AEs reported as tx-related were mostly G1-2 and included fatigue and nausea (21.4% each), vomiting (14.3%), rash (11.9%) and pruritus (9.5%). AEs reported as tx-related that were ≥ G3 in > 1 pt were elevated AST and ALT (2 pts, at 450 and 600 mg). AEs reported as tx-related that resulted in tx discontinuation were G3 fatigue, G2 QTc prolongation, G2 drug hypersensitivity, G2 pneumonitis (1 pt each), and G3 pruritus/G2 rash (same pt). GDC-0917 peak concentrations were observed 2-3h post dosing. Exposure was dose-proportional with a mean plasma elimination t1/2of 4-8h and no apparent accumulation at steady state. Rapid down-modulation of cIAP1 was observed in PBMCs at all dose levels. Evaluation of tumor biopsies demonstrated decreases in cIAP1 (2 pts total, at 40 and 200 mg) and increases in activated caspase-3 and cPARP (1 pt at 200 mg). Two pts (4.8%) had a complete response (both unconfirmed, ovarian Ca and MALT lymphoma [PET]); 4 pts (9.5%) had stable disease for ≥ 3 months.
Conclusions: GDC-0917 had a favorable safety, PK and PD profile in pts with advanced malignancies. These encouraging results support further clinical evaluation of this agent. Clinical trial information: NCT01226277.
Questi sono i dati che devono provare l’abilità di Curis nell’aver ottenuto da Genentech un farmaco valido ad un prezzo stracciato. Come ho avuto modo di anticipare, anche se non in modo palese, credo che in questo tipo di affare Genentech abbia voluto in parte compensare il contratto capestro imposto da Roche (di cui Genentech è sussidiaria) nei confronti di Curis.
Mi spiego meglio. Al momento di contrattare le condizioni legate alla concessione dei diritti di Erivedge, Roche ha preso per la gola (nel senso violento della frase) Curis forte della propria posizione dominante e delle difficoltà della small cap americana. Ora Curis si trova con royalties modeste a discapito di un valore scientifico elevato, avendo realizzato e portato all’approvazione in primo Hedgehog inibitore battendo concorrenti molto più attrezzati. Erivedge funziona benissimo in pazienti con carcinoma basocellulare (BCC), ma le vendite stentano a decollare e comunque i ricavi di Curis sono viziati da quella stipula.
Ora, non sto certo dicendo che Genentech abbia concesso un programma di elevato valore a Curis per compensare tale situazione per puro spirito altruistico, ma mi sono quasi del tutto convinto che abbiano ceduto a Curis un programma potenzialmente efficace, ma del quale Genentech non vuole affrontare la sperimentazione, pur di mantenere dei sani e proficui rapporti.
Bene, tolte le mie elucubrazioni sulle strategie delle due società, cosa ci suggerisce l’abstract presentato ad ASCO?
Iniziamo col dire che lo studio vede 42 pazienti con un’età media di 60 anni suddivisi in 11 coorti e che lo scopo principale dello studio era relativo a farmacocinetica, individuazione del dosaggio maggiore possibile, sicurezza ed amenità simili. Chiaramente quello che interessa a noi è anche e soprattutto l’efficacia.
I pazienti arruolati dovevano rispondere a tre criteri di inclusione, la presenza di un tumore avanzato, metastatico o un linfoma per cui non esistano terapie approvate o si siano rivelate inefficaci o verso le quali il soggetto si sia dimostrato intollerante; aspettativa di vita maggiore di 3 mesi e funzionamento ematologico e degli organi adeguato; per le donne in età fertile e per gli uomini con partner con le stesse caratteristiche, l’accordo ad impiegare metodi contraccettivi per tutta la durata dello studio. Ovviamente il primo criterio è quello con maggiore significato dal mio punto di vista: stiamo parlando di pazienti pretrattati senza opzioni terapeutiche perseguibili.
I dati hanno evidenziato due risposte complete (CR, tutte e due non confermate), una in una paziente con carcinoma ovarico ed una in un caso di una rara forma di linfoma non-Hodgkin. Il tasso di CR è stato del 4,8% ed il tasso di controllo della malattia del 14,3%. Non sono numeri che fanno girare la testa.
Ma i numeri non sono tutto.
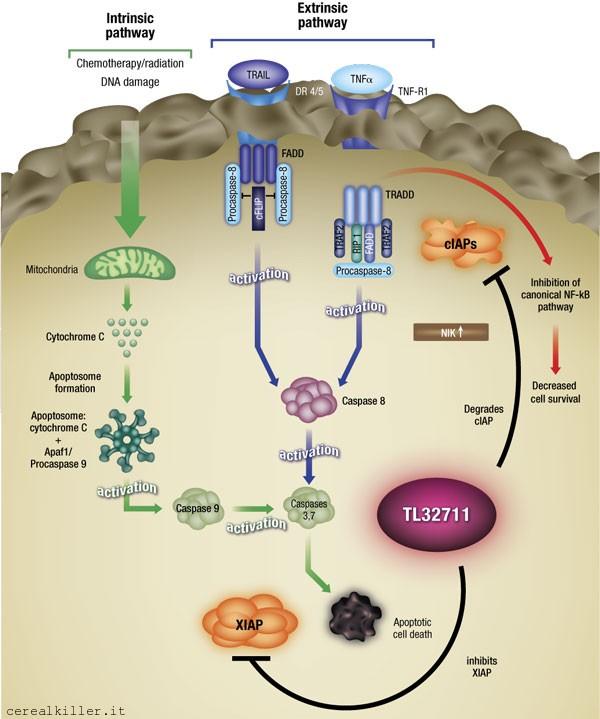
In questa edizione di ASCO ho trovato solo un altro abstract relativo ad uno IAP inibitore paragonabile a quello di Curis, si ratta di Birinapant di TetraLogic Pharmaceuticals. Il meccanismo d’azione di questo SMAC mimetico è riassunto nell’immagine qui sotto, prelevata direttamente dal loro sito.
SMAC sta per Second Mitochondrial-derived Activator of Caspases e la funzione di Birinapant è quella di essere antagonista delle proteine inibitrici dell’apoptosi (IAP), queste ultime responsabili della soppressione delle caspasi, ossia quelle proteine che regolano la risposta apoptica e cioè la morte programmata della cellula. In termini più comprensibili, alcune cellule tumorali scampano all’apoptosi (cioè la morte) grazie ad una sovra-espressione di inibitori dell’apoptosi (gli IAP), serve quindi un inibitore di questi inibitori (cioè gli IAP inibitori). Ridondante? Forse sarebbe meglio chiamare questi farmaci IAP agonisti, ma il concetto lo avete afferrato.
Ad ASCO TetraLogic porta l’abstract relativo ad uno studio di fase 2 condotto su 51 pazienti affetti da cancro del colon-retto (CRC), precedentemente trattati con una media di 4 linee terapeutiche e per il 92% refrattari od intolleranti ad Irinotecan. Ci sono state 2 risposte parziali fra i pazienti a cui è stato somministrato birinapant ed irinotecan (4%) e 27 casi di malattia stabile (53%) per un tasso di controllo della malattia del 57%. La progressione libera da malattia (PFS) è stata di 2,1 mesi nella popolazione ITT. Nei soggetti con mutazione KRAS la PFS è stata di 2,9 mesi vs 1,4 mesi per i pazienti con KRAS wild type, dato interessante se si considera che Irinotecan non ha finora dimostrato un vantaggio su pazienti con KRAS mutato. Ora, i dati son da prendere con tutte le cautele del caso e come spesso ripeto, paragonare due studi clinici è estremamente complicato, ma alcune osservazioni si possono fare in parallelo a CUDC 427.
Tanto per cominciare CUDC 427 come agente singolo non ha quasi nessun futuro, stessa cosa però si può dire di Birinapant che infatti nello studio in esame è impiegato in combinazione. CUDC 427 come singolo agente ha dato luogo a due risposte complete anche se il tasso di controllo della malattia è stato basso, ma è lecito aspettarsi una efficacia ancora maggiore nel caso dell’uso assieme ad un altro farmaco. Le due risposte sono state in due indicazioni totalmente differenti tra l’altro, permettendo di ipotizzare un’uso piuttosto ampio del farmaco. Il rovescio della medaglia è costituito dalla mancanza apparente di una chiara indicazione da seguire, anche se in questo senso l’aiuto di Genentech potrebbe rivelarsi assai prezioso.
Altro aspetto positivo che emerge da ASCO riguarda le biopsie dei tumori che hanno evidenziato una riduzione di cIAP1 ed un incremento dell’attivazione della caspasi 3, anche se qui i numeri sono ancor più bassi. Confortante anche il profilo di sicurezza, aspetto che in questo caso diventa ancor più importante, dovendo partire dal presupposto che il farmaco dovrà essere utilizzato in combinazione.
ASCO a parte, allo scorso San Antonio Breast Cancer Symposium (SABCS), Novartis ha presentato dati provenienti da uno studio su pazienti con cancro al seno triplo negativo (TNBC) trattate con paclitaxel ed ilm proprio IAP inibitore LCL 161. Il risultato? 1 risposta completa e 15 parziali su 52 arruolati.
Come potete vedere, le due risposte complete di CUDC 427 presentate ad ASCO sono un segnale incoraggiante che personalmente incuriosisce molto.
Curis ha più volte ribadito di voler iniziare una fase 2 verso metà anno. Presumibilmente l’indicazione con cui partiranno sarà simile a quella di Novartis, ossia il cancro al seno, anche se sulla presenza di pazienti con TNBC non metterei la mano sul fuoco. Il farmaco con cui verrà testato? Xeloda. Di Roche, ovviamente.

http://www.4-traders.com/CURIS-INC-8898/news/Curis-Inc-Curis-Announces-Initiation-of-a-Clinical-Trial-of-CUDC-427-In-Advanced-Malignancies-17126898/
Ahahahaha… grazie bello. Approfitto per chiedere scusa a tutti, l’articolo su molmed slitta a domani, ci sono due cosette che devo controllare. Per $CRIS… non ci si poteva attendere dati miracolosi, per l’insostenibilità della tesi del “buon samaritano genentech”. I dati però meritano una seconda occhiata, a mio avviso. Poi, non è per dire, ma oggi tutto è andato a sud in USA… ok ASCO sottotono, ma mi pare si esageri… o c’è altro sotto 😉
Mamma mia, sono in macchina scusate l’ortografia….
Andrea complimenti anche per la strategia su aveo….
Ciao
Ciao Grande!
Eccoci qui, ha chiederci se cris cala per il tuo articolo oppure perche’ nessuno lo ha letto…
Mitico!